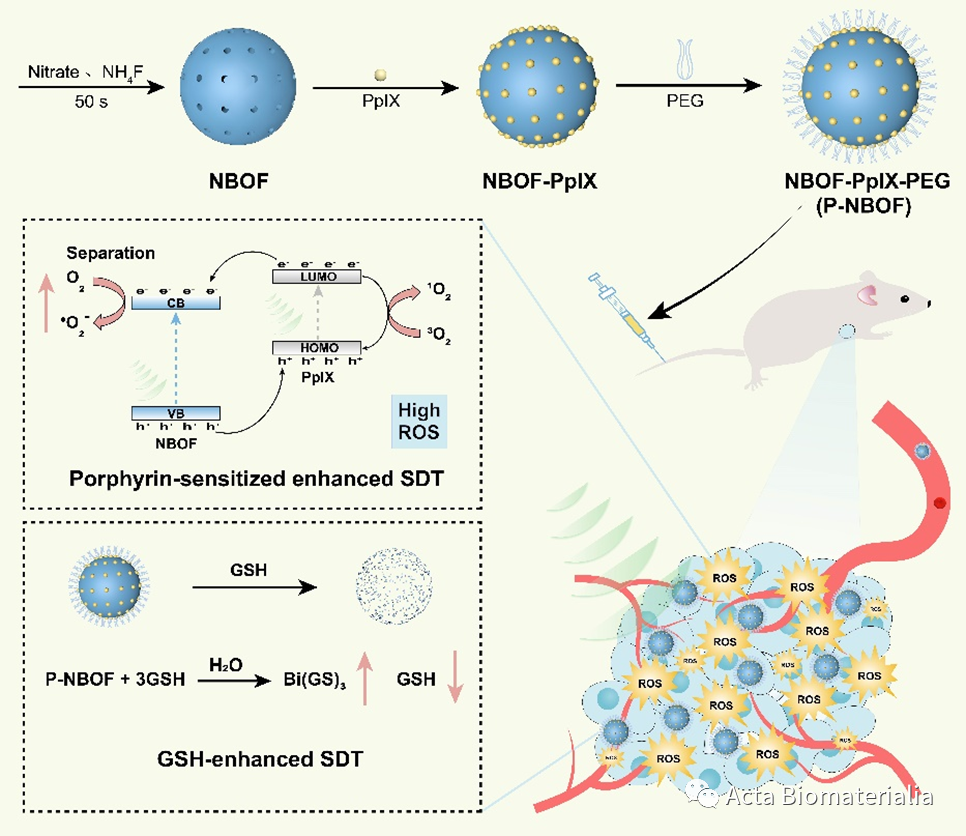
声动力治疗(SDT)是一种非侵入性且副作用小的精准肿瘤治疗方式,但目前已有的声动力治疗声敏剂存在种类少且疗效欠佳等问题。基于提高声敏剂活性氧(ROS)产生能力和降低活性氧清除速率等策略,本研究中,上海理工大学铋科学研究中心李钰皓副教授和缪煜清教授团队报道了一种原卟啉敏化铋基纳米半导体作为声动力治疗声敏剂(P-NBOF)以产生活性氧和协同耗损谷胱甘肽增强肿瘤声动力治疗的疗效。实验结果表明,皮下荷瘤小鼠通过尾静脉注射P-NBOF和两次超声治疗后,肿瘤生长得到了有效的抑制。对肿瘤组织的免疫荧光染色进一步证实经声动力治疗肿瘤部位产生了大量的活性氧。另外,通过体内外实验证明铋基纳米声敏剂具有良好的生物安全性,是一种可代谢的纳米声敏剂。声动力治疗疗效的提升一方面源于铋基纳米材料是一种宽带隙半导体,原卟啉的敏化作用使其更容易在超声波激发下将激发的电子注入铋基纳米半导体的导带增强还原能力,从而产生更多的超氧阴离子自由基。同时P-NBOF也有助于增加敏化剂原卟啉的电荷分离,从而产生更多的单线态氧。另一方面,P-NBOF还可在肿瘤微环境中降解并不断消耗谷胱甘肽,有利于打破肿瘤微环境中的氧化还原平衡,增强声动力治疗疗效。该复合型铋基纳米声敏剂作为一种可降解纳米声敏剂,在癌症声动力治疗领域具有重要实际意义。
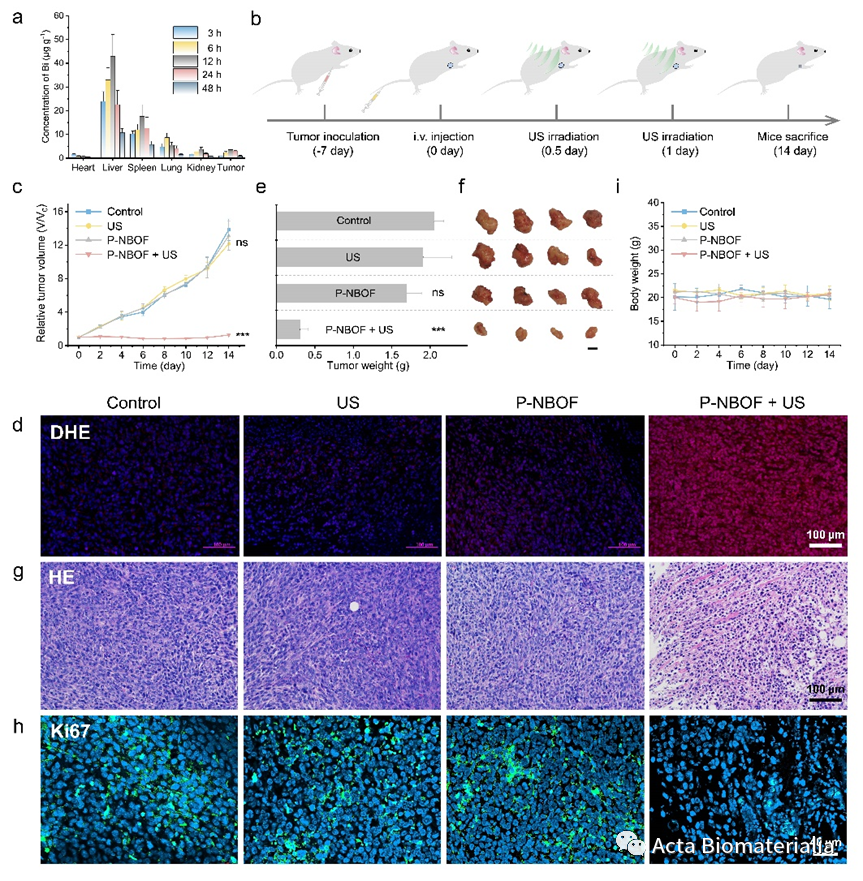
图2.(a)P-NBOF在不同时间下的生物分布。(b)荷瘤小鼠的治疗过程示意图。(c)各治疗组别中荷瘤小鼠的平均肿瘤生长曲线。(d)各治疗组别中肿瘤内活性氧染色图像。(e)各治疗组中肿瘤重量及(f)治疗14天后对应肿瘤照片(标尺:1cm)。治疗14天后各治疗组肿瘤组织切片的(g)H&E和(h)Ki67染色图像。(i)治疗过程中各治疗组荷瘤小鼠的体重。
Kang Song#, Guobo Chen#, Zongyan He, Jing Shen, Jing Ping, Yuhao Li*, Lulu Zheng, Yuqing Miao, Dawei Zhang, Protoporphyrin-sensitized degradable bismuth nanoformulations for enhanced sonodynamic oncotherapy, Acta Biomaterialia, 2023.
https://doi.org/10.1016/j.actbio.2022.12.065.
来源:Acta Biomaterialia
